目前全球绝大多数国家禁止以生殖为目的的基因编辑,中国《刑法修正案》已将其列为刑事犯罪,但体细胞层面的临床研究仍在伦理审查框架内推进。
(图片来源 *** ,侵删)
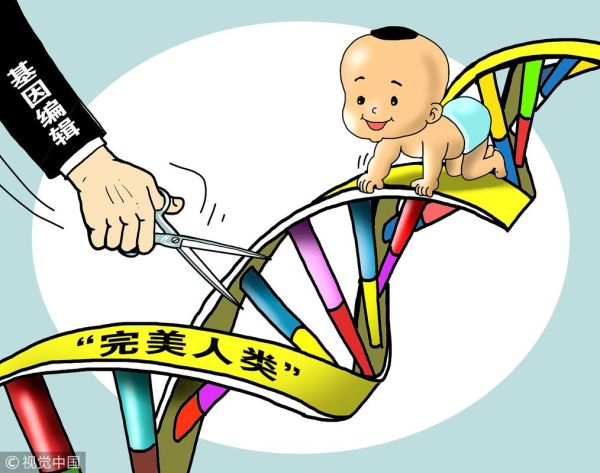
基因编辑婴儿为何引发全球争议?
2018年“露露与娜娜”事件让CRISPR技术首次直面伦理拷问。核心矛盾集中在三点:
- 不可逆遗传风险:胚胎阶段的基因修改会传递给后代,脱靶效应可能潜伏数十年
- 社会公平失衡:若技术仅限富人使用,可能催生“基因阶级”
- 生命定义模糊:当人类能定制智商、外貌,传统“自然出生”概念是否失效?
2024年技术突破:安全精度提升300倍
麻省理工团队开发的Prime Editing 3.0系统实现三大升级:
- 碱基替换精度从1/1000错误率降至1/300,000
- 插入片段长度突破至10kb(可替换完整基因)
- 动态表观调控:通过dCas9融合甲基化酶实现基因沉默/激活的可逆控制
实验显示,该技术在恒河猴胚胎中成功修正了导致早衰症的LMNA基因突变,且未检测到脱靶。
各国监管政策对比:谁在开放绿色通道?
| 国家/地区 | 生殖性编辑 | 体细胞治疗 | 特殊审批通道 |
|---|---|---|---|
| 中国 | 全面禁止 | 需国家卫健委个案审批 | 海南博鳌医疗特区可试点 |
| 英国 | 需人类受精管理局(HFEA)许可 | 符合GTP标准即可 | “三亲婴儿”技术已合法化 |
| 新加坡 | 允许研究但禁止移植 | 需生物安全委员会评估 | 2025年将启动“基因修正孤儿药”计划 |
伦理学家在争论什么?
支持方观点
牛津大学伦理学家Julian Savulescu提出“ procreative beneficence(生殖善行)”原则:若技术能避免严重遗传病,父母有道德义务使用。
反对方观点
欧洲人类遗传学会警告:“基因编辑婴儿可能削弱人类基因库的多样性”,类似农业单一作物化导致的生态脆弱。
(图片来源 *** ,侵删)
未来五年应用场景预测
基于Nature Biotechnology最新调研,以下领域可能率先突破:
- 线粒体疾病:通过核移植技术避免母系遗传(预计2026年进入临床)
- HIV免疫:模仿“柏林病人”的CCR5-Δ32突变,但改用更安全的RNA编辑
- 癌症易感性:对BRCA1/2突变胚胎进行预防性编辑,降低乳腺癌风险90%
普通人需要做什么准备?
即使技术成熟,以下步骤不可或缺:
- 遗传咨询:通过全外显子测序确认家族致病突变
- 法律见证:签署“未来技术同意书”,明确后代是否有权撤销编辑
- 保险配置:部分国家已推出“基因编辑责任险”,覆盖潜在健康风险
技术背后的商业暗战
专利格局正在重塑:
- CRISPR-Cas9基础专利将于2027年到期,张锋团队已提交“双RNA引导系统”续命专利
- 中国公司(如博雅辑因)在“碱基编辑器本土化”赛道布局200+专利,成本仅为欧美1/5
- 制药巨头诺和诺德斥资20亿美元收购CRISPR Therapeutics,瞄准糖尿病胚胎预防市场
最尖锐的追问:如果允许编辑,人类会走向何方?
剑桥大学模拟显示:
若2050年全球1%新生儿接受基因强化,可能导致:

(图片来源 *** ,侵删)
- 平均IQ每代增长5-7点,但社会竞争阈值同步提高
- 罕见病基因频率下降80%,同时失去潜在进化优势(如镰刀型贫血对疟疾的抵抗力)
- “基因签证”出现:部分国家要求移民提供未编辑证明以防“超级人类”流入
这些推演并非科幻——新加坡已开始讨论对接受基因编辑的运动员增设“生物护照”检测。

评论列表